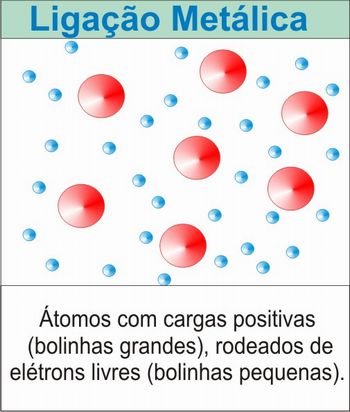
A Ligação Metálica é a atracção entre iões positivos e eletrões livres. Os eletrões são "livres" pois, como os elementos metálicos têm poucos eletrões de valência, libertam-se facilmente, ficando atraídos pelo seu próprio núcleo como também pelos núcleos vizinhos, podendo mover-se em todas as direcções.
Esta ligação apenas ocorre nos metais.
sexta-feira, 31 de janeiro de 2014
Ligação Iónica
A Ligação Iónica é a transferência de electrões com tendência a libertar eletrões (iões positivos) para átomos com tendência a captá-los (iões negativos).
Esta ligação ocorre nos metais e nos não-metais.
Exemplo:
Esta ligação ocorre nos metais e nos não-metais.
Exemplo:
Ligações Covalentes
A Ligação Covalente consiste na partilha de pares de eletrões de valência entre os átomos com tendência para captar eletrões.
Este tipo de ligação acontece no hidrogénio e nos não-metais.
A Fórmula de Estrutura evidencia a ligação covalente através de traços (cada traço corresponde a 1 par de eletrões de valência).
Existem 3 tipos de ligação covalente:
- Ligação Covalente Simples --> é a partilha de 1 par de eletrões de valência;

- Ligação Covalente Dupla --> é a partilha de 2 pares de eletrões de valência;

- Ligação Covalente Tripla --> é a partilha de 3 pares de eletrões de valência;

Este tipo de ligação acontece no hidrogénio e nos não-metais.
A Fórmula de Estrutura evidencia a ligação covalente através de traços (cada traço corresponde a 1 par de eletrões de valência).
Existem 3 tipos de ligação covalente:
- Ligação Covalente Simples --> é a partilha de 1 par de eletrões de valência;

- Ligação Covalente Dupla --> é a partilha de 2 pares de eletrões de valência;

- Ligação Covalente Tripla --> é a partilha de 3 pares de eletrões de valência;

Subscrever:
Mensagens (Atom)